电化学在生活中的应用
应用电化学课件
学习目标
1、熟练掌握原电池的电极名称、电子流向、电极反应式及原电池总反应式;
2、掌握几种新型燃料电池的工作原理;
3、熟练掌握电解池电极名称、材料、电解质种类等的判断;会书写电极反应式和电解总反应方程式;
4、掌握电解前后溶液的浓度和pH值变化的计算。
典型例题
【例1】⑴今有2H2+O2 2H2O反应,构成燃料电池,则负极通的应是
,正极通的应是 ,电极反应式为负极: ,正极: 。
⑵若把KOH改为稀H2SO4作电解质,则电极反应式为负极: ,
正极: 。⑴和⑵的电解质不同,反应进行后,其溶液的pH个有什么变化 。
⑶若把H2改为CH4,用KOH作电解质,则电极反应式为负极: ,正极 。
【例2】 (2003年南通四市联考试题)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 __g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶___∶_ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH ___。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
课堂练习
1、蓄电池在放电时起原电池作用,在充电时起电解池作用,
下列是爱迪生蓄电池分别在充电和放电时的反应:Fe +NiO2+2H2O 放电充电Fe(OH)2+ Ni(OH)2,下列有关爱迪生蓄电池的推断中不正确的是( )
A.放电时Fe作负极,NiO2作正极
B.放电时溶液中的阳离子向正极移动
C.充电时的阴极反应是Fe(OH)2 +2e- == Fe + 2OH-
D.该蓄电池既可用KOH溶液又可用稀H2SO4作电解质溶液
2、生物体中细胞膜内的葡萄糖与细胞膜外富氧液体及细胞膜构成微型的生物原电池。下列有关电极反应及产物的判断正确的是:
A.负极反应可能是O2+2H2O+4e- =4OH-
B.负极反应的产物主要是C6H12O6 被氧化生成的CO32-、HCO3-、H2O
C.正极反应可能是6C6H12O6-24e- + 24OH-==6CO2+18H2O
D.正极反应的产物主要是C6H12O6生成的CO2、CO32-、H2O
3、下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是( )
A.Cu、Ag、AgNO3溶液 B.Zn、Cu 浓H2SO4
C.Fe、Zn、CuSO4溶液 D.Fe、C、Fe2(SO4)3溶液
4.(多选)用石墨做电极电解AlCl3溶液时,下列电解液变化曲线合理的是( )
A B C D
5.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生bL氧气(标准状况),则M的相对原子质量为( )
A. B. C. D.
6.摩托罗拉公司最新研发了一种由甲醇和氧气及强碱作电解质溶液的新型手机电池,电量可达现用锂电池的10倍,且待机时间超过一个月。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32- 。
⑴该电池总反应的离子方程式为——————————————————————————————————————;
⑵甲醇是————极,电池在放电过程中溶液的pH将_________(填“下降”或“上升”、不变”);若有16g 甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO4溶液(假设整个过程中能量总利用率为80%),则将产生标准状况下的O2 ______升。
⑶最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体大是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
① 电池的正极反应式为_________________,
② 放电时固体电解质里O2-离子的移动方向是向_______极移动(填正或负)。
7、1991年我国首创以铝、空气和海水电池为能源的新型海水航标灯.它以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就发出耀眼的闪光,其能量比干电池高20~50倍.根据以上叙述,填写这种电池两极的电极反应式:
(1)负极: .
(2)正极: .
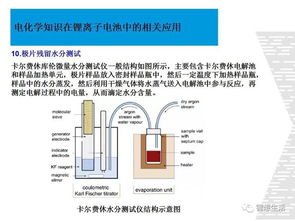
电化学知识点总结
一、原电池
课标要求
1、掌握原电池的工作原理
2、熟练书写电极反应式和电池反应方程式
要点精讲
1、原电池的工作原理
(1)原电池概念:化学能转化为电能的装置,叫做原电池。
若化学反应的过程中有电子转移,我们就可以把这个过程中的电子转移设计成定向的移动,即形成电流。只有氧化还原反应中的能量变化才能被转化成电能;非氧化还原反应的能量变化不能设计成电池的形式被人类利用,但可以以光能、热能等其他形式的能量被人类应用。
(2)原电池装置的构成
①有两种活动性不同的金属(或一种是非金属导体)作电极。
②电极材料均插入电解质溶液中。
③两极相连形成闭合电路。
(3)原电池的工作原理
原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。负极发生氧化反应,正极发生还原反应,简易记法:负失氧,正得还。
2、原电池原理的应用
(1)依据原电池原理比较金属活动性强弱
①电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。
②在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。
③原电池的正极通常有气体生成,或质量增加;负极通常不断溶解,质量减少。
(2)原电池中离子移动的方向
①构成原电池后,原电池溶液中的阳离子向原电池的正极移动,溶液中的阴离子向原电池的负极移动;
②原电池的外电路电子从负极流向正极,电流从正极流向负极。
注:外电路:电子由负极流向正极,电流由正极流向负极;
内电路:阳离子移向正极,阴离子移向负极。
3、原电池正、负极的判断方法:
(1)由组成原电池的两极材料判断
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断
原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
(5)根据电极质量增重或减少来判断。
工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。
(6)根据有无气泡冒出判断
电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。
本节知识树
原电池中发生了氧化还原反应,把化学能转化成了电能。
二、化学电源
课标要求
1、了解常见电池的种类
2、掌握常见电池的工作原理
要点精讲
1、一次电池
(1)普通锌锰电池
锌锰电池是最早使用的干电池。锌锰电池的电极分别是锌(负极)和碳棒(正极),内部填充的是糊状的MnO2和NH4Cl。电池的两极发生的反应是:
(2)碱性锌锰电池
用KOH电解质溶液代替NH4Cl作电解质时,无论是电解质还是结构上都有较大变化,电池的比能量和放电电流都能得到显著的提高。它的电极反应如下:
(3)银锌电池――纽扣电池
该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。其电极反应式为:
(4)高能电池――锂电池
该电池是20世纪70年代研制出的一种高能电池。由于锂的相对原子质量很小,所以比容量(单位质量电极材料所能转换的电量)特别大,使用寿命长。
如作心脏起搏器的锂碘电池的电极反应式为:
2、二次电池
原理:充电电池在放电时进行的氧化还原反应在充电时又逆向进行,生成物重新转化为反应物,使充电放电可在一定时期内循环进行。
铅蓄电池
构成:该电池以Pb和PbO2作电极材料,硫酸作电解质溶液。
放电时二氧化铅电极上发生还原反应,铅电极上发生氧化反应。充电时二氧化铅电极上发生氧化反应,铅电极上发生还原反应。
3、氢氧燃料电池
(1)氢氧燃料电池的构造
在氢氧燃料电池中,电解质溶液为KOH溶液。石墨为电极,H2和O2或空气)源源不断地通到电极上。
(2)氢氧燃料电池的优点是产物只有水,不产生污染物。
本节知识树
根据原电池的工作原理,设计了各种用途的原电池产品。需要了解常见电池的基本构造、工作原理、性能和使用范围。
三、电解池
课标要求
点击展开全文#art_sho 0;position:absolute;z-index:900;botto;;padding:0;%;height:50px;border-botto solid #f9f9f9;background-i-gradient(hsla(0,0%,100%,0),#f9f9f9);color:#1c6bcc;text-align:center;line-height:170px}#art_sho{position:relative;font-size:14px}#art_sho,#art_sho{position:absolute;top:-20px;left:50%;display:inline-block;-left:-4px;;height:8px;border-botto solid #1c6bcc;border-left:1px solid #1c6bcc;content:' ';transfor(-45deg)}#art_sho{top:-15px}

