临床试验方案一般包括哪些内容,临床试验方案设计通常包括哪些内容
大家好,今天我为大家详解和临床试验方案一般包括哪些内容相关的一些问题点,并且临床试验方案设计通常包括哪些内容也一样有许多人对其还不熟悉,所以,在这篇文章里,我会尽力帮大家整理和分析这个问题。接下来,我们一起深入理解和学习吧!如果这篇文章对你们有帮助,欢迎关注和分享我们的网站,谢谢!
临床试验方案指说明临床试验目的
临床试验方案是指在临床试验开始之前,根据试验目的和设计要求,制定的一份详细的研究计划。该计划旨在确保试验的合理性和科学性,以确保试验结果的可靠性和可重复性。
在临床试验方案中,通常会详细说明以下内容:
1、试验目的:明确研究的目的和背景,以及试验所需解决的问题。
2、研究设计:说明试验的设计方案,包括试验分期、分组和随机化方法等。
3、研究人群:明确研究对象的入选标准和排除标准,以及如何招募和筛选受试者。
4、样本量:说明所需样本量的计算方法和依据,以及如何进行样本量的调整。
5、试验流程:详细描述试验流程,包括治疗方案、观察指标、评估方法和数据采集等。
6、统计分析方法:说明数据分析的统计学方法,包括数据分析方法、数据质量监控和异常值处理等。
7、研究伦理:说明研究的伦理原则和研究者的职责等。
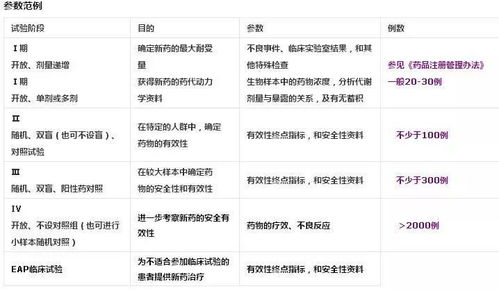
临床试验是指在人体(病人或健康志愿者)进行药物的系统性研究,目的是确定试验药物的疗效与安全性。临床试验有着严格的设计和实施标准,以确保试验的可靠性和科学性。
临床试验分为哪三大类型
随机对照试验:是最常用的临床试验设计之一,其目的是通过将参与者随机分配到试验组或对照组,来比较两种治疗方案的效果。试验组接受新的试验药物或治疗方法,而对照组则接受传统的标准治疗或安慰剂。这种试验设计可以减少偏倚和选择性偏差,从而提高试验的内部效度和外部效度。
非随机同期对照试验:是将试验组和对照组的受试者放置在同一时间段内进行试验,并根据受试者的病史和检查结果进行配对比较。这种试验设计的优点是可以更好地控制选择性偏差,但也可能存在一些偏倚和混淆因素。
交叉设计试验:是一种特殊的临床试验设计,其目的是比较两种不同治疗方案的效果。该设计需要每个受试者先后接受两种不同的治疗方案,并进行相应的评估和比较。交叉设计试验的优点是可以减少样本量,但也可能存在一些偏倚和混淆因素。
临床试验方案中一般不对合并用药作出规定
临床试验方案中一般不对合并用药作出规定。这句话是错误的,临床试验方案中一般对合并用药作出规定。
临床试验方案(clinical trial protocol)是2018年公布的核医学名词,出自《核医学名词》第一版。
定义:临床研究设计的书面文件。包括试验背景、理论基础和研究目的、试验的设计、方法学、组织和统计学及试验执行和排除的条件。
试验方案必须由有关研究者或研究机构和资助者署明日期和签字,并经有关主管部门审核批准,有法律合同的意义。
临床试验方案通常包括:
A.基本信息
B.研究背景资料
C.试验目的
D.试验设计
E.实施方式(方法、内容、步骤)
临床试验方案设计通常包括哪些内容
临床试验方案设计通常包括哪些内容介绍如下:
1、试验开始前必须获得国家食品药品监督管理总局(简称CFDA)药物临床试验批件。
2、临床研究方案设计,记录表编制,SOP制定。
3、伦理委员会审定I期临床研究方案、知情同意书、病例报告表等试验相关文件。
4、研究人员培训,I期病房的准备。
5、通过体检初选自愿受试者,然后进一步全面检查,合格者入选。
6、试验开始前,对合格入选的受试者签订知情同意书。
7、数据录入与统计分析。
8、总结分析。
扩展资料
临床试验方案的内容要求
1、方案必须严格遵守中国注册法规要求。
2、符合法规基本要求(疗效指标要选择符合金标准和SFDA注册要求的指标,不要选那些新的研究方向指标,注册不是搞科研)。
3、需要与主要研究者和新审中心讨论(新审中心没有针对方案内容做严格要求)避免不应有的错误方案的内容应该清晰和简洁。
4、受试者的入选标准,排除标准和剔除标准,选择受试者的步骤,受试者分配的方法;根据统计学原理计算要达到试验预期目的所需要的病例数。
5、试验药品的剂型、剂量、给药途径、给药方法、给药次数、疗程和有关合并用药的规定,以及对包装和标签的说明。

