高中有机化学知识点归纳
有机物知识点总结
一、重要的物理性质
1.有机物的溶解性
(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:
① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
② 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
③有的淀粉、蛋白质可溶于水形成胶体。蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
2.有机物的密度
小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂)
3.有机物的状态[常温常压(1个大气压、20℃左右)]
(1)气态:
① 烃类:一般N(C)≤4的各类烃 注意:新戊烷[C(CH3)4]亦为气态
② 衍生物类:
一氯甲烷(CH3Cl,沸点为-24.2℃) 甲醛(HCHO,沸点为-21℃)
(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。如,
己烷CH3(CH2)4CH3 甲醇CH3OH
甲酸HCOOH 乙醛CH3CHO
特殊:
不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态
(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。如,
石蜡 C12以上的烃
饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态
4.有机物的颜色
绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色
淀粉溶液(胶)遇碘(I2)变蓝色溶液;
含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
5.有机物的气味
许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味:
甲烷:无味
乙烯:稍有甜味(植物生长的调节剂)
液态烯烃:汽油的气味
乙炔:无味
苯及其同系:芳香气味,有一定的毒性,尽量少吸入。
一卤代烷:不愉快的气味,有毒,应尽量避免吸入。
C4以下的一元醇:有酒味的流动液体
C5~C11的一元醇:不愉快气味的油状液体
C12以上的一元醇:无嗅无味的蜡状固体
乙醇:特殊香味
乙二醇:甜味(无色黏稠液体)
丙三醇(甘油):甜味(无色黏稠液体)
乙醛:刺激性气味
乙酸:强烈刺激性气味(酸味)
低级酯:芳香气味
二、重要的反应
1.能使溴水(Br2/H2O)褪色的物质
(1)有机物
通过加成反应使之褪色:含有、—C≡C—的不饱和化合物
通过氧化反应使之褪色:含有—CHO(醛基)的有机物
通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯
(2)无机物
① 通过与碱发生歧化反应
3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O
② 与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+
2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质
(1)有机物:含有、—C≡C—、—CHO的物质
与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应)
(2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+
3.与Na反应的有机物:
含有—OH、—COOH的有机物
与NaOH反应的有机物:常温下,易与含有酚羟基、—COOH的有机物反应
加热时,能与酯反应(取代反应)
与Na2CO3反应的有机物:含有酚羟基的有机物反应生成酚钠和NaHCO3;
含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;
与NaHCO3反应的有机物:含有—COOH的有机物反应生成羧酸钠并放出等物质的量的CO2气体。
4.银镜反应的有机物
(1)发生银镜反应的有机物:
含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等)
(2)银氨溶液[Ag(NH3)2OH](多伦试剂)的配制:
向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。
(3)反应条件:碱性、水浴加热
若在酸性条件下,则有Ag(NH3)2+ + OH - + 3H+ == Ag+ + 2NH4+ + H2O而被破坏。
(4)实验现象:试管内壁有银白色金属析出
(5)有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3
AgOH + 2NH3·H2O == Ag(NH3)2OH + 2H2O
银镜反应的一般通式: RCHO + 2Ag(NH3)2OH2 Ag↓+ RCOONH4 + 3NH3 + H2O
甲醛(相当于两个醛基):HCHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2CO3 + 6NH3 + 2H2O
乙二醛: OHC-CHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2C2O4 + 6NH3 + 2H2O
甲酸: HCOOH + 2 Ag(NH3)2OH2 Ag↓+ (NH4)2CO3 + 2NH3 + H2O
葡萄糖: (过量)
CH2OH(CHOH)4CHO +2Ag(NH3)2OH2Ag↓+CH2OH(CHOH)4COONH4+3NH3 + H2O
(6)定量关系:—CHO~2Ag(NH)2OH~2 Ag HCHO~
5.与新制Cu(OH)2悬浊液(斐林试剂)的反应
(1)有机物:羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽糖)、甘油等多羟基化合物。
(2)斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液(即斐林试剂)。
(3)反应条件:碱过量、加热煮沸
(4)实验现象:
① 若有机物只有官能团醛基(—CHO),则滴入新制的氢氧化铜悬浊液中,常温时无变化,加热煮沸后有(砖)红色沉淀生成;
② 若有机物为多羟基醛(如葡萄糖),则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有(砖)红色沉淀生成;
(5)有关反应方程式:
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
RCHO + 2Cu(OH)2RCOOH + Cu2O↓+ 2H2O
HCHO + 4Cu(OH)2CO2 + 2Cu2O↓+ 5H2O
OHC-CHO + 4Cu(OH)2HOOC-COOH + 2Cu2O↓+ 4H2O
HCOOH + 2Cu(OH)2CO2 + Cu2O↓+ 3H2O
CH2OH(CHOH)4CHO +
2Cu(OH)2CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O
—CHO~2Cu(OH)2~Cu2O HCHO~4Cu(OH)2~2Cu2O
高中有机物知识点总结
蛋白质
蛋白质的基本组成单位是氨基酸,生物体中组成蛋白质的氨基酸大约有20种,在结构上都符合结构通式。氨基酸分子间以肽键的方式互相结合。由两个氨基酸分子缩合而成的化合物称为二肽,由多个氨基酸分子缩合而成的化合物称为多肽,其通常呈链状结构,称为肽链。一个蛋白质分子可能含有一条或几条肽链,通过盘曲﹑折叠形成复杂(特定)的空间结构。蛋白质分子结构具有多样性的特点,其原因是:构成蛋白质的氨基酸种类不同、数目成百上千、氨基酸排列顺序千变万化、多肽链形成的空间结构千差万别。由于结构的多样性,蛋白质在功能上也具有多样性的特点,其功能主要如下:(1)结构蛋白,如肌肉、载体蛋白、血红蛋白;(2)信息传递,如胰岛素(3)免疫功能,如抗体;(4)大多数酶是蛋白质如胃蛋白酶(5)细胞识别,如细胞膜上的糖蛋白。总而言之,一切生命活动都离不开蛋白质,蛋白质是生命活动的主要承担者。
脱水缩合:一个氨基酸分子的氨基(-NH2)与另一个氨基酸分子的羧基(-COOH)相连接,同时失去一分子水。
有关计算:
① 肽键数 = 脱去水分子数 = 氨基酸数目 - 肽链数
② 至少含有的羧基(-COOH)或氨基数(-NH2) = 肽链数
核酸
核酸是遗传信息的载体,是一切生物的遗传物质,对于生物体的遗传和变异、蛋白质的生物合成有极其重要作用。核酸包括脱氧核糖核酸(DNA)和核糖核酸(RNA)两大类,基本组成单位是核苷酸,由一分子含氮碱基﹑一分子五碳糖和一分子磷酸组成。组成核酸的碱基有5种,五碳糖有2种,核苷酸有8种。
脱氧核糖核酸简称DNA,主要存在于细胞核中,细胞质中的线粒体和叶绿体也是它的载体。
核糖核酸简称RNA,主要存在于细胞质中。对于有细胞结构(同时含DNA和RNA)的生物,其遗传物质就是DNA;没有细胞结构的病毒,有的遗传物质是DNA如:噬菌体等;有的遗传物质是RNA如:烟草花叶病毒、HIV等
细胞中的糖类和脂质
糖类分子都是由C、H、O三种元素组成。糖类是细胞的主要能源物质。
糖类可分为单糖、二糖和多糖等几类。单糖是不能再水解的糖, 常见的有葡萄糖、果糖、半乳糖、核糖、脱氧核糖,其中葡萄糖 是细胞的重要能源物质,核糖和脱氧核糖一般不作为能源物质,它们是核酸的组成成分;二糖中蔗糖和麦芽糖是植物糖,乳糖、糖原是动物糖;多糖中糖原 是动物糖 ,淀粉和纤维素是植物糖 ,糖原和淀粉是细胞中重要的储能物质。
脂质主要是由C H O 3种化学元素组成,有些还含有P (如磷脂) 。脂质包括脂肪、磷脂、和固醇。脂肪是生物体内的储能物质。 除此以外,脂肪还有保温、缓冲、减压的作用;磷脂是构成包括细胞膜在内的膜物质重要成分;固醇类物质主要包括胆固醇、性激素、维生素D等,这些物质对于生物体维持正常的生命活动,起着重要的调节作用。
多糖、蛋白质、核酸等都是生物大分子,组成它们的基本单位分别是单糖(葡萄糖)﹑氨基酸和核苷酸,这些基本单位称为单体,这些生物大分子就称为单体的多聚体,每一个单体都以若干个相连的碳原子构成的碳链为基本骨架,由许多单体连接成多聚体 。
细胞内有机物质的鉴定
糖类中的还原糖(葡萄糖、果糖)能与斐林试剂发生作用,生成砖红色沉淀;
脂肪可以被苏丹Ⅳ染成橘黄色;蛋白质与双缩脲试剂发生作用,产生紫色反应。在还原糖的检测中,斐林试剂甲液和乙液应等量混合均匀后再使用,并且要水裕加热;在蛋白质的检测中,在组织样液中应先加入双缩脲试剂A液1,再加入双缩脲试剂B液4滴,不需加热。
甲基绿能使DNA呈现绿色,吡罗红能使RNA呈现红色,因此利用这两种染色剂将细胞染色,可以显示DNA和RNA在细胞中的分布。在此实验中,盐酸的作用是改变膜的通透性,加速色素进入细胞。用人的口腔上皮细胞做实验材料,此实验的步骤是制片、水解、冲洗涂片、染色、观察。
有机化合物知识点的分享已经结束,希望考生可以认真仔细的复习,发挥出自己的潜力。
高中有机化合物知识点总结
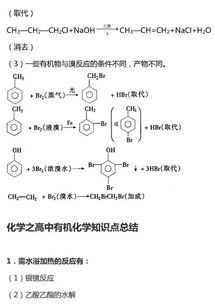
1、能发生消去反应的是:乙醇(浓硫酸,170℃);卤代烃(如CH3CH2Br)醇发生消去反应的条件:C—C—OH、卤代烃发生消去的条件:C—C—XHH
2、能作为衡量一个国家石油化工水平的标志的是:乙烯的产量
3、能发生酯化反应的是:醇和酸
4、燃烧产生大量黑烟的是:C2H2、C6H6
5、属于天然高分子的是:淀粉、纤维素、蛋白质、天然橡胶(油脂、麦芽糖、蔗糖不是)
6、属于三大合成材料的是:塑料、合成橡胶、合成纤维
7、常用来造纸的原料:纤维素
8、常用来制葡萄糖的是:淀粉
9、能发生皂化反应的是:油脂
10、水解生成氨基酸的是:蛋白质
11、水解的最终产物是葡萄糖的是:淀粉、纤维素、麦芽糖
12、能与Na2CO3或NaHCO3溶液反应的有机物是:含有—COOH:如乙酸
13、能与Na2CO3反应而不能跟NaHCO3反应的有机物是:苯酚
14、有毒的物质是:甲醇(含在工业酒精中);NaNO2(亚硝酸钠,工业用盐)
15、能与Na反应产生H2的是:含羟基的物质(如乙醇、苯酚)、与含羧基的物质(如乙酸)
16、能还原成醇的是:醛或酮
17、能氧化成醛的醇是:R—CH2OH
18、能作植物生长调节剂、水果催熟剂的是:乙烯
高中有机化合物知识点总结
1、能与活泼金属反应置换出氢气的物质:醇、酚、羧酸。
2、能发生缩聚反应的物质:苯酚(C6H5OH)与醛(RCHO)、二元羧酸(COOH—COOH)与二元醇(HOCH2CH2OH)、二元羧酸与二元胺(H2NCH2CH2NH2)、羟基酸(HOCH2COOH)、氨基酸(NH2CH2COOH)等。
3、需要水浴加热的实验:制硝基苯(—NO2,60℃)、制苯磺酸(—SO3H,80℃)制酚醛树脂(沸水浴)、银镜反应、醛与新制Cu(OH)2悬浊液反应(热水浴)、酯的水解、二糖水解(如蔗糖水解)、淀粉水解(沸水浴)。
4、光
光照条件下能发生反应的:烷烃与卤素的取代反应、苯与氯气加成反应(紫外光)、—CH3+Cl2—CH2Cl(注意在铁催化下取代到苯环上)。
5、常用有机鉴别试剂:新制Cu(OH)2、溴水、酸性高锰酸钾溶液、银氨溶液、NaOH溶液、FeCl3溶液。
6、最简式为CH的有机物:乙炔、苯、苯乙烯(—CH=CH2);最简式为CH2O的有机物:甲醛、乙酸(CH3COOH)、甲酸甲酯(HCOOCH3)、葡萄糖(C6H12O6)、果糖(C6H12O6)。
7、能发生银镜反应的物质(或与新制的Cu(OH)2共热产生红色沉淀的):醛类(RCHO)、葡萄糖、麦芽糖、甲酸(HCOOH)、甲酸盐(HCOONa)、甲酸酯(HCOOCH3)等。
8、常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、C=C(碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、 —NH—CO—(肽键)、—NO2(硝基)
9、常见有机物的通式:烷烃:CnH2n+2;烯烃与环烷烃:CnH2n;炔烃与二烯烃:CnH2n-2;苯的同系物:CnH2n-6;饱和一元卤代烃:CnH2n+1X;饱和一元醇:CnH2n+2O或CnH2n+1OH;苯酚及同系物:CnH2n-6O或CnH2n-7OH;醛:CnH2nO或CnH2n+1CHO;酸:CnH2nO2或CnH2n+1COOH;酯:CnH2nO2或CnH2n+1COOC+1
10、检验酒精中是否含水:用无水CuSO4——变蓝
高中有机化合物知识点总结
1、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CCl4、氯仿、液态烷烃等。
5、能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
8、属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2=CHCOOH)及其酯(CH3CH=CHCOOCH3)、油酸甘油酯等。
10、能发生水解的物质:金属碳化物(CaC2)、卤代烃(CH3CH2Br)、醇钠(CH3CH2ONa)、酚钠(C6H5ONa)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)((C6H10O5)n)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。

